Belajar kimia pada dasarnya menjawab banyak hal yang terjadi di sekitar kita, tanpa disadari. Mulai dari bagaimana reaksi yang terjadi dalam tubuh kita, hingga reaksi kimia yang ada dan kita gunakan dalam kehidupan sehari-hari. Kimia membantu Anda memahami fenomena mengapa besi dapat berkarat dan mengapa es dapat mengapung.
Selain itu, hal-hal sederhana yang mudah kita temui di sekitar kita juga memiliki penjelasannya dalam kimia. Misalnya baterai dan prinsip kerja dalam baterai. Konsep yang terjadi pada baterai dibahas lebih lanjut dalam pelajaran kimia pada materi elektrokimia. Baterai yang dapat mengeluarkan arus listrik tersebut merupakan contoh dari elektrokimia, yaitu cabang ilmu kimia yang memperlihatkan hubungan arus listrik dengan suatu reaksi kimia. Dalam hal ini, reaksi kimia dapat menghasilkan arus listrik dan sebaliknya, arus listrik juga dapat menghasilkan reaksi kimia. Perubahan arus listrik menjadi reaksi kimia dan sebaliknya inilah yang menjelaskan tentang apa yang terjadi pada sel volta dan sel elektolisis.
Apa itu sel volta? Bagaimana rangkaian sel volta? Bagaimana rumus e sel pada sel volta? Dan apa contoh sel volta dalam kehidupan sehari-hari? Yuk simak penjelasan lengkapnya berikut ini. Kali ini, kami akan lebih banyak membahas terkait sel volta.
Selain itu Anda juga bisa mempelajari jenis-jenis ikatan kimia untuk meningkatkan pemahaman sains Anda!

Apa Itu Sel Volta?
Sel Volta adalah salah satu jenis sel elektrokimia yang berfungsi mengubah energi kimia menjadi energi listrik melalui reaksi redoks spontan. Reaksi ini terjadi antara dua elektroda dalam larutan elektrolit, menghasilkan aliran elektron yang menciptakan arus listrik.
Nama Sel Volta diambil dari dua ilmuwan besar, Luigi Galvani dan Alessandro Volta, yang berkontribusi dalam pengembangan rumus elektrokimia. Oleh sebab itu, sel volta juga dikenal sebagai Sel Galvani.
Alessandro Volta, seorang ilmuwan Italia, pertama kali mempelajari reaksi elektrokimia pada tahun 1796. Dalam eksperimennya, ia menggunakan pelat perak dan pelat seng yang dihubungkan oleh larutan elektrolit garam. Percobaannya membuktikan bahwa reaksi kimia dapat menghasilkan arus listrik melalui transfer elektron. Penemuan Volta ini menjadi dasar dalam penciptaan baterai pertama di dunia, yang hingga kini menjadi teknologi utama dalam penyimpanan energi listrik.
Rumus Potensial Sel Volta
Untuk menghitung beda potensial listrik yang dihasilkan oleh sel volta, digunakan rumus e0 sel (rumus e nol sel):
E⁰_{sel} = E⁰_{katoda} - E⁰_{anoda}
Dimana:
- E⁰ sel = potensial listrik yang dihasilkan oleh sel volta (Volt)
- E⁰ katoda = potensial reduksi elektroda katoda (Volt)
- E⁰ anoda = potensial reduksi elektroda anoda (Volt)
Jika E⁰ sel > 0, maka reaksi berjalan secara spontan, yang berarti sel dapat menghasilkan listrik.
Selain itu Anda juga bisa mempelajari perbedaan antara senyawa ion dan senyawa kovalen!
Rangkaian sel volta
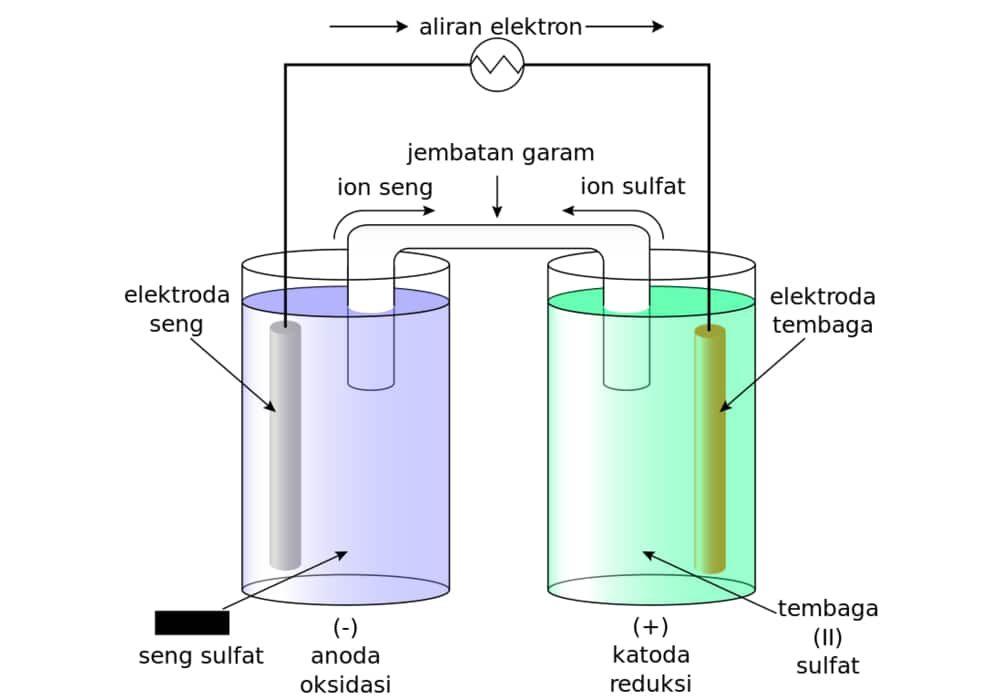
Rangkaian sel volta adalah susunan komponen yang memungkinkan terjadinya reaksi redoks spontan untuk menghasilkan energi listrik. Prinsip dasar dari rangkaian ini adalah pemindahan elektron dari zat yang mengalami oksidasi (anoda) ke zat yang mengalami reduksi (katoda) melalui rangkaian luar. Berikut adalah urutan sel volta:
1. Elektroda (Anoda dan Katoda)
Elektroda adalah logam yang digunakan sebagai tempat terjadinya reaksi redoks dalam sel volta. Ada dua jenis elektroda dalam sel volta:
- Anoda (bermuatan negatif) → tempat reaksi oksidasi terjadi.
- Logam pada anoda kehilangan elektron dan larut dalam larutan elektrolit.
- Contoh: Zinc (Zn) sebagai anoda dalam sel Zn-Cu.
- Reaksi yang terjadi di anoda: Zn(s)→Zn2+(aq)+2e−Zn(s) \rightarrow Zn^{2+} (aq) + 2e^-
- Katoda (bermuatan positif) → tempat reaksi reduksi terjadi.
- Logam pada katoda menerima elektron yang datang dari anoda melalui rangkaian luar.
- Contoh: Copper (Cu) sebagai katoda dalam sel Zn-Cu.
- Reaksi yang terjadi di katoda: Cu2+(aq)+2e−→Cu(s)
Dalam sel volta, anoda mengalami korosi karena logamnya larut dalam larutan, sedangkan katoda mengalami pertumbuhan massa karena ion-ion logam dari larutan mengendap di elektroda.
2. Larutan Elektrolit
Larutan elektrolit adalah medium penghantar ion yang memungkinkan terjadinya reaksi redoks dan perpindahan elektron dalam sel volta. Elektrolit ini mengandung ion-ion yang berperan dalam reaksi oksidasi dan reduksi.
- Contoh larutan elektrolit dalam sel Zn-Cu:
- Larutan seng sulfat (ZnSO₄) mengandung ion Zn²⁺ untuk reaksi oksidasi.
- Larutan tembaga(II) sulfat (CuSO₄) mengandung ion Cu²⁺ untuk reaksi reduksi.
Jika elektrolit tidak ada, maka reaksi tidak akan terjadi karena tidak ada medium untuk pergerakan ion.
3. Jembatan Garam
Jembatan garam adalah tabung kecil yang berisi larutan garam inert, seperti Kalium Klorida (KCl) atau Natrium Sulfat (Na₂SO₄).
Fungsi jembatan garam dalam rangkaian sel volta adalah:
- Menyeimbangkan muatan ion dalam larutan elektrolit.
- Menghubungkan dua setengah sel tanpa mencampurkan larutan elektrolit secara langsung.
- Memastikan reaksi tetap berlangsung dengan memungkinkan pergerakan ion-ion antara dua larutan.
Tanpa jembatan garam, sel volta akan mengalami ketidakseimbangan muatan dan reaksi akan terhenti.
4. Voltmeter
Voltmeter adalah alat yang digunakan untuk mengukur beda potensial listrik (tegangan) yang dihasilkan oleh sel volta. Voltmeter dihubungkan antara katoda dan anoda untuk membaca tegangan yang dihasilkan dari reaksi redoks.
Reaksi Sel volta
Reaksi sel volta sering disebut dengan reaksi redoks. Redoks merupakan singkatan dari reduksi-oksidasi, dua jenis reaksi yang selalu terjadi berpasangan. Satu zat kehilangan elektron (oksidasi) dan zat lain menerima elektron (reduksi). Jenis reaksi ini biasa disebut Katoda anoda
Reaksi di Anoda (Oksidasi)
Anoda adalah elektroda tempat terjadinya reaksi oksidasi. Dalam sel volta, anoda memiliki muatan negatif. Logam yang sering digunakan sebagai anoda adalah seng (Zn). Reaksi oksidasi yang terjadi di anoda adalah sebagai berikut:
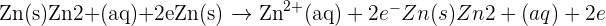
Dalam reaksi ini, atom seng (Zn) kehilangan dua elektron untuk membentuk ion seng (Zn²⁺). Elektron-elektron yang dilepaskan oleh atom seng kemudian mengalir melalui sirkuit luar menuju katoda.
Reaksi di Katoda (Reduksi)
Katoda adalah elektroda tempat terjadinya reaksi reduksi. Dalam sel volta, katoda memiliki muatan positif. Logam yang sering digunakan sebagai katoda adalah tembaga (Cu). Reaksi reduksi yang terjadi di katoda adalah sebagai berikut:
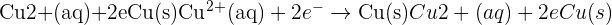
Dalam reaksi ini, ion tembaga (Cu²⁺) dalam larutan menerima dua elektron yang datang dari anoda, membentuk tembaga padat (Cu). Reaksi ini menyebabkan pertumbuhan massa pada katoda karena tembaga padat mengendap di permukaan elektroda.
Catatan:
| Anoda | Katoda |
|---|---|
| Mengalami oksidasi | Mengalami reduksi |
| Melepas elektron | Menerima elektron |
| Bermuatan negatif | Bermuatan positif |

Bagaimana Cara Menentukan Katoda dan Anoda dalam Sel Volta?
Menentukan katoda dan anoda sangat penting untuk memahami arah aliran elektron dalam rangkaian sel volta. Berikut adalah cara mengetahui katoda dan anoda:
1. Menggunakan Potensial Reduksi Standar
Cara paling akurat adalah dengan membandingkan nilai potensial reduksi standar (E0E⁰).
- Logam dengan potensial reduksi lebih rendah → menjadi anoda (tempat oksidasi terjadi).
- Logam dengan potensial reduksi lebih tinggi → menjadi katoda (tempat reduksi terjadi).
Contoh:
Diketahui potensial reduksi standar untuk:
- Zn²⁺ + 2e⁻ → Zn (s), E0=−0.76VE⁰ = -0.76V
- Cu²⁺ + 2e⁻ → Cu (s), E0=+0.34VE⁰ = +0.34V
Karena E⁰ Cu lebih besar daripada E⁰ Zn, maka:
- Cu menjadi katoda (reduksi).
- Zn menjadi anoda (oksidasi).
2. Urutan Reaktivitas Logam
Logam yang lebih reaktif lebih mudah kehilangan elektron, sehingga menjadi anoda. Logam yang kurang reaktif lebih cenderung menerima elektron, sehingga menjadi katoda.
Urutan reaktivitas logam (dari anoda ke katoda): Li > K > Ca > Na > Mg > Al > Zn > Fe > Ni > Sn > Pb > H > Cu > Hg > Ag > Au
Dari urutan ini:
- Logam di sebelah kiri lebih mudah mengalami oksidasi → menjadi anoda.
- Logam di sebelah kanan lebih sulit teroksidasi (lebih mudah mengalami reduksi) → menjadi katoda.
Notasi Sel Volta
Notasi sel volta adalah cara sistematis untuk menuliskan reaksi yang terjadi di dalam sel volta. Notasi ini mencakup komponen-komponen sel, jenis reaksi yang terjadi di setiap elektroda, serta hubungan antara elektroda dan larutan elektrolit. Notasi sel volta membantu dalam memahami dan memvisualisasikan reaksi redoks yang terjadi dalam sel volta dengan cara yang ringkas dan terstruktur.
Komponen dalam Notasi Sel Volta
Notasi sel volta melibatkan beberapa komponen utama:
- Elektroda Anoda (Reaksi Oksidasi)
- Elektroda Katoda (Reaksi Reduksi)
- Larutan Elektrolit di Anoda
- Larutan Elektrolit di Katoda
- Jembatan Garam (dalam beberapa kasus)
Format Notasi Sel Volta
Notasi sel volta ditulis dalam format berikut:
Anoda (reaksi oksidasi) ∣ Larutan elektrolit anoda ∣∣ Larutan elektrolit katoda ∣ Katoda (reaksi reduksi)
Penjelasan Komponen Notasi
- Anoda (reaksi oksidasi): Menunjukkan elektroda dan reaksi oksidasi yang terjadi di anoda. Anoda adalah tempat di mana atom-atom logam kehilangan elektron dan membentuk ion.
- Larutan elektrolit anoda: Menunjukkan larutan yang mengandung ion dari logam yang teroksidasi di anoda.
- Katoda (reaksi reduksi): Menunjukkan elektroda dan reaksi reduksi yang terjadi di katoda. Katoda adalah tempat di mana ion-ion logam menerima elektron dan membentuk logam padat.
- Larutan elektrolit katoda: Menunjukkan larutan yang mengandung ion yang direduksi di katoda.
- Jembatan Garam (||): Menunjukkan adanya jembatan garam yang menghubungkan dua larutan elektrolit, menjaga keseimbangan muatan ion.
Gambar Sel Volta
Berikut adalah gambar sel volta yang menunjukkan komponen utama dan reaksi yang terjadi di dalamnya:
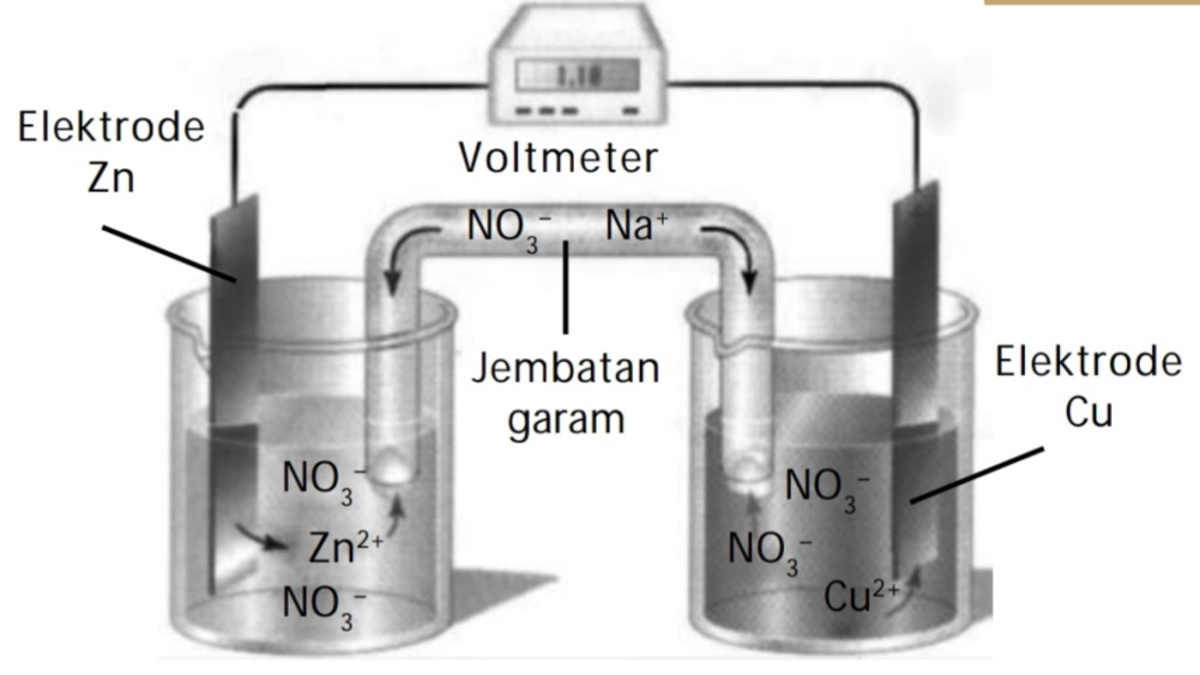
Gambar ini menunjukkan bagaimana elektroda seng (Zn) sebagai anoda dan elektroda tembaga (Cu) sebagai katoda terhubung melalui larutan elektrolit dan jembatan garam. Aliran elektron dari anoda ke katoda menghasilkan arus listrik yang dapat digunakan untuk berbagai aplikasi.
Apakah sel volta mengandung senyawa ion dan kovalen?
Aplikasi Sel Volta dalam Kehidupan Sehari-hari
Sel volta, atau yang juga dikenal sebagai sel galvani, adalah perangkat elektrokimia yang mengubah energi kimia menjadi energi listrik melalui reaksi redoks yang spontan. Sel volta memiliki banyak aplikasi dalam kehidupan sehari-hari yang sangat penting dan mendasar bagi berbagai perangkat dan teknologi yang kita gunakan setiap hari. Berikut adalah beberapa aplikasi utama sel volta dalam kehidupan sehari-hari:
1. Baterai
Baterai adalah salah satu aplikasi sel volta yang paling umum dan dikenal. Baterai terdiri dari satu atau lebih sel volta yang terhubung secara seri atau paralel untuk menghasilkan tegangan dan arus listrik yang diperlukan. Baterai digunakan dalam berbagai perangkat elektronik, seperti:
- Remote Control: Remote control untuk televisi, AC, dan perangkat elektronik lainnya menggunakan baterai sel kering untuk mengoperasikan.
- Jam Tangan dan Jam Dinding: Jam tangan dan jam dinding menggunakan baterai kecil untuk menjaga ketepatan waktu.
- Mainan Elektronik: Banyak mainan anak-anak yang membutuhkan baterai untuk berfungsi, seperti mobil remote control dan boneka yang dapat berbicara.
- Perangkat Medis: Beberapa perangkat medis portabel, seperti alat pacu jantung dan glucometer, menggunakan baterai untuk beroperasi.
Jenis-jenis Baterai:
- Baterai Alkalin: Baterai ini menggunakan seng (Zn) sebagai anoda dan mangan dioksida (MnO2) sebagai katoda. Baterai alkalin dikenal karena daya tahannya yang lebih lama dibandingkan dengan baterai sel kering biasa.
- Baterai Lithium: Baterai lithium menggunakan litium sebagai anoda dan berbagai senyawa logam sebagai katoda. Baterai ini memiliki kepadatan energi yang tinggi dan digunakan dalam perangkat berteknologi tinggi seperti ponsel pintar dan laptop.
- Baterai Nikel-Kadmium (NiCd) dan Nikel-Metal Hidride (NiMH): Kedua jenis baterai ini dapat diisi ulang dan sering digunakan dalam perangkat yang membutuhkan daya tahan lama dan kemampuan pengisian ulang, seperti kamera digital dan alat elektronik portabel lainnya.
2. Aki
Aki, atau baterai timbal-asam, adalah jenis baterai yang sering digunakan dalam kendaraan bermotor. Aki terdiri dari beberapa sel volta yang menggunakan timbal (Pb) sebagai anoda dan timbal dioksida (PbO2) sebagai katoda. Elektrolit yang digunakan adalah asam sulfat (H2SO4). Aki mampu menghasilkan arus listrik yang besar dan dapat diisi ulang, sehingga sangat ideal untuk kendaraan bermotor seperti mobil dan sepeda motor.
Kegunaan Aki:
- Starter Kendaraan: Aki menyediakan arus listrik yang diperlukan untuk menghidupkan mesin kendaraan.
- Sistem Listrik Kendaraan: Aki juga menyediakan daya untuk sistem listrik kendaraan seperti lampu, radio, dan sistem kontrol elektronik.
- Kendaraan Listrik: Pada kendaraan listrik, aki atau baterai digunakan sebagai sumber utama daya untuk menggerakkan motor listrik.
3. Sel Bahan Bakar
Sel bahan bakar adalah perangkat yang menggunakan reaksi kimia antara bahan bakar (biasanya hidrogen) dan oksigen untuk menghasilkan listrik. Sel bahan bakar tidak seperti baterai tradisional yang memiliki kapasitas terbatas; selama ada pasokan bahan bakar, sel bahan bakar dapat terus menghasilkan listrik.
Aplikasi Sel Bahan Bakar:
- Kendaraan Listrik: Sel bahan bakar hidrogen digunakan dalam beberapa kendaraan listrik untuk menyediakan sumber energi yang bersih dan efisien. Contoh kendaraan yang menggunakan teknologi ini termasuk Toyota Mirai dan Honda Clarity.
- Pembangkit Listrik Portabel: Sel bahan bakar digunakan dalam perangkat pembangkit listrik portabel yang dapat digunakan di lokasi terpencil atau dalam situasi darurat.
- Daya Cadangan: Sel bahan bakar dapat digunakan sebagai sumber daya cadangan untuk gedung komersial dan fasilitas kritis seperti rumah sakit dan pusat data.
4. Alat Elektronik Portabel

Banyak alat elektronik portabel yang kita gunakan sehari-hari bergantung pada sel volta untuk beroperasi. Beberapa contohnya termasuk:
- Laptop dan Ponsel Pintar: Perangkat ini menggunakan baterai lithium-ion yang memiliki kepadatan energi tinggi, memungkinkan penggunaan yang lama dan pengisian ulang yang cepat.
- Tablet dan E-Reader: Perangkat ini juga menggunakan baterai lithium-ion atau lithium-polymer untuk daya tahan yang lebih lama dan desain yang lebih ramping.
- Kamera Digital dan Camcorder: Baterai rechargeable seperti NiMH atau lithium-ion digunakan dalam kamera digital dan camcorder untuk memastikan kinerja yang handal selama penggunaan intensif.
5. Peralatan Rumah Tangga
Beberapa peralatan rumah tangga juga menggunakan sel volta sebagai sumber energi, seperti:
- Senter: Banyak senter menggunakan baterai sel kering atau baterai rechargeable untuk menyediakan cahaya di area yang gelap.
- Timbangan Dapur: Timbangan elektronik menggunakan baterai kecil untuk mengoperasikan sensor dan layar digital.
- Alarm Kebakaran: Banyak alarm kebakaran menggunakan baterai untuk memastikan bahwa perangkat tetap berfungsi selama pemadaman listrik.
6. Alat Medis
Baterai sel volta juga digunakan dalam berbagai alat medis portabel yang penting untuk diagnosis dan pengobatan. Beberapa contohnya adalah:
- Alat Pacu Jantung: Alat pacu jantung menggunakan baterai lithium-iodida yang memiliki masa pakai panjang dan dapat diandalkan untuk mempertahankan fungsi jantung.
- Glucometer: Alat pengukur gula darah portabel menggunakan baterai untuk pengoperasian dan penyimpanan data.
- Pompa Insulin: Pompa insulin menggunakan baterai untuk mengatur aliran insulin bagi penderita diabetes.
7. Perangkat Keamanan
Perangkat keamanan juga memanfaatkan sel volta untuk operasi yang handal dan terus menerus. Contoh perangkat keamanan yang menggunakan sel volta adalah:
- Kamera Pengawas: Banyak kamera pengawas menggunakan baterai sebagai sumber daya cadangan jika terjadi pemadaman listrik.
- Alarm Keamanan: Sistem alarm rumah dan kantor menggunakan baterai untuk memastikan bahwa perangkat tetap berfungsi selama pemadaman listrik.
8. Perangkat IoT (Internet of Things)
Perangkat IoT yang semakin populer juga menggunakan baterai sel volta untuk daya. Beberapa contohnya adalah:
- Sensor Rumah Pintar: Sensor untuk pengaturan suhu, deteksi gerakan, dan monitoring lingkungan menggunakan baterai untuk operasi nirkabel.
- Perangkat Wearable: Smartwatch, fitness tracker, dan perangkat wearable lainnya menggunakan baterai lithium-ion kecil untuk daya tahan lama dan pengisian cepat.
Memahami konsep sel volta mungkin terdengar rumit pada awalnya, tetapi sebenarnya sangatlah mudah jika Anda memiliki panduan yang tepat. Sel volta adalah dasar dari banyak perangkat yang kita gunakan sehari-hari, seperti baterai dan aki, yang menjadikannya topik yang sangat bermanfaat untuk dipelajari.
Jika Anda ingin mendalami lagi tentang materi sel volta dan sel elektrolisis, materi eter, tentang molaritas, atau materi kimia lainnya, Superprof adalah tempat yang tepat untuk Anda. Dengan ribuan tutor berpengalaman dan berpengetahuan luas di bidang kimia, Superprof siap membantu Anda memahami setiap konsep dengan jelas dan mudah.
Ringkaskan dengan AI