Saat mendengar kata kimia, yang mungkin muncul di benak Anda adalah seseorang yang memakai jas laboratorium berwarna putih sedang bekerja dengan mikroskop dan cairan kimia berwarna-warni. Hal tersebut wajar saja, karena dalam kimia memang terdapat cairan warna-warni seperti ungu, hijau, biru, merah dan warna-warna lainnya. Namun, tahukah Anda bahwa tidak semua cairan kimia memiliki warna-warna menarik seperti ini? Hanya zat-zat yang memiliki konfigurasi elektron dan diagram orbital tertentu saja yang punya warna menarik.
Hmm, lalu apa itu konfigurasi elektron dan diagram orbital? Seperti apa cara konfigurasi elektron atau diagram orbital? Jangan khawatir, pada artikel ini, kami akan membahas materi konfigurasi elektron dan diagram orbital dalam kimia dengan mudah. Yuk, simak penjelasan selengkapnya berikut ini!

Konfigurasi Elektron
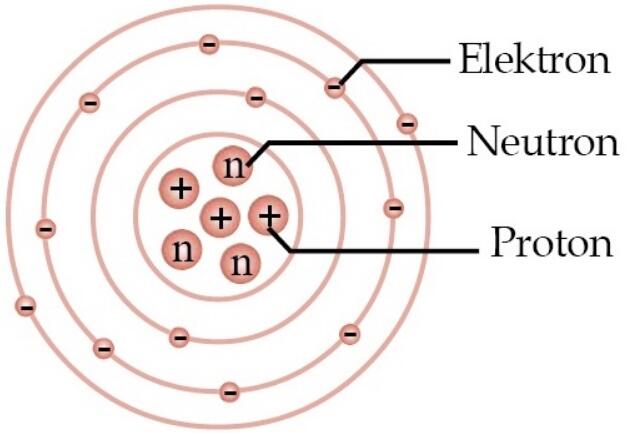
Konfigurasi elektron adalah susunan penyebaran (pengisian) elektron-elektron dalam tingkat energi di sekitar inti atom. Seperti yang sudah kita ketahui, bahwa pada struktur atom terdapat subatomik neutron dan proton yang terdapat pada inti atom, serta elektron yang bergerak mengelilingi inti atom pada kulit-kulit elektron dengan level energi yang berbeda-beda.
Kulit-kulit elektron ini menjadi lintasan peredaran elektron. Kulit pertama yang terdekat dengan inti atom disebut kulit K, kemudian kulit kedua disebut kulit L, kulit ketiga disebut kulit M, dan seterusnya berurutan sesuai alfabet semakin menjauhi inti atom. Kulit elektron ini juga dapat dinyatakan dengan bilangan kuantum utama (n), dimulai dari 1 untuk kulit K, 2 untuk kulit L, dan seterusnya. Semakin besar nilai n, semakin jauh kulit elektron dari inti atom, dan semakin besar energi elektron yang bereda di kulit tersebut.
Urutan konfigurasi elektron disempurnakan dengan model mekanika kuantum yang menggunakan empat jenis subkulit untuk menggambarkan orbital elektron dalam suatu atom. Untuk membuat konfigurasi elektron dengan teori mekanika kuantum, ada gambar yang perlu Anda pahami sebelum membuat konfigurasi elektron berdasarkan orbital atom.
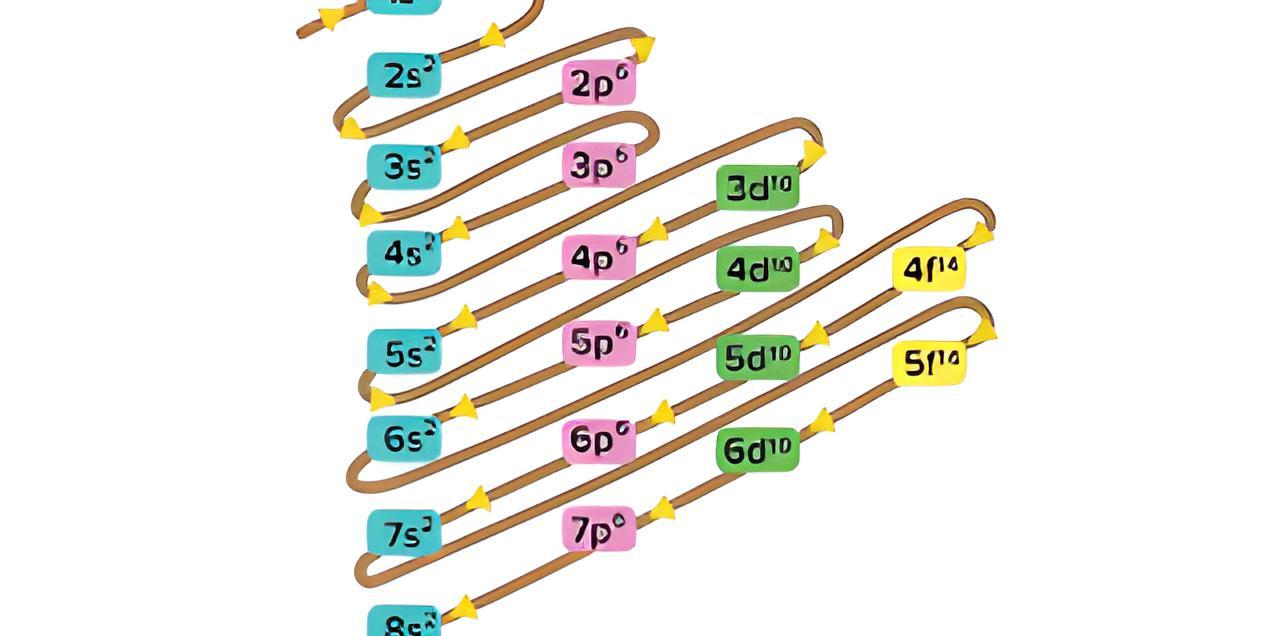
Gambar di atas adalah urutan tingkat energi kulit dan subkulit suatu atom. Ada 4 subkulit yaitu s, p, d, dan f, dan angka sebelum subkulit menunjukkan kulit. Subkulit 1s punya tingkat energi paling rendah, lalu naik ke subkulit 2s, 2p, 3s, 3p, sampai terakhir yang paling tinggi 8s. Elektron yang mengisi subkulit ini dituliskan dalam bentuk pangkat. Elektron yang mengisi subkulit ini dituliskan dalam bentuk pangkat. Subkulit s maksimal terisi 2 elektron (s²), p terisi 6 elektron (p⁶), d terisi 10 elektron (d¹⁰), dan f terisi 14 elektron (f¹⁴).
Apakah Anda sudah mengetahui bentuk molekul? Silahkan baca artikel kami lainnya!
Aturan Penuh/Setengah Penuh

Aturan penuh dan setengah penuh pada konfigurasi kulit atom menyatakan bahwa suatu elektron dapat berpindah ke orbital lain untuk mencapai susunan yang lebih stabil. Aturan ini diterapkan untuk konfigurasi elektron yang memiliki akhir subkulit d.
Misalnya pada atom Cu dengan jumlah elektron 29 memiliki konfigurasi sub kulit akhir 3d. Tanpa menggunakan aturan penuh/setengah penuh, konfigurasi atom Cu adalah 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁹. Namun dengan aturan setengah penuh, orbital 3d cenderung mengambil elektron dari 4s untuk mencapai total 10 elektron, sehingga menjadi Cu: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ 3d¹⁰.
Subkulit d ini yang biasanya akan mengalami proses kimia lebih lanjut sehingga menghasilkan warna. Itu sebabnya sebagian besar zat kimia dari logam transisi bisa menghasilkan warna.
Jika Anda juga ingin belajar tentang bilangan oksidasi, pastikan Anda membaca artikel ini!
Diagram Orbital
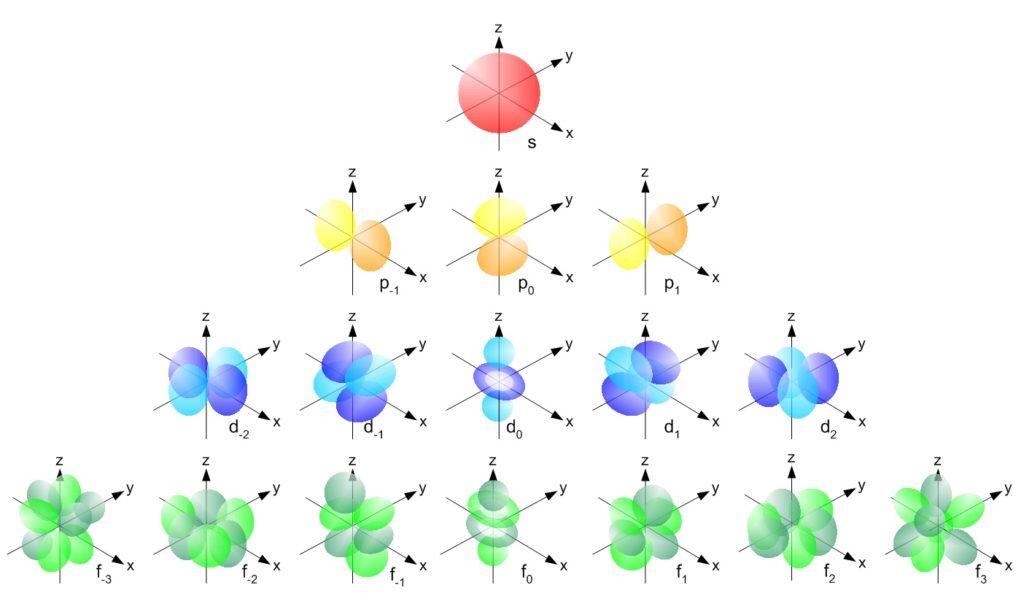
Orbital adalah bagian dari sub kulit atom yang menggambarkan daerah di sekitar inti atom di mana kemungkinan besar elektron dapat ditemukan. Setiap orbital kimia memiliki bentuk dan ukuran yang berbeda-beda tergantung pada tingkat energi dan jenis subkulitnya. Secara sederhana, diagram orbital adalah gambaran visual dari distribusi elektron yang mengisi orbital-orbital dalam atom. Diagram ini membantu kita memahami bagaimana elektron ditempatkan dalam subkulit atom yang berbeda, serta bagaimana mereka berinteraksi dalam hal energi dan posisi. Konsep ini sangat penting untuk mempelajari struktur atom dan sifat-sifat kimia unsur-unsur.
Diagram orbital adalah alat yang sangat berguna dalam kimia karena memungkinkan kita untuk menggambarkan distribusi elektron dalam suatu atom dengan cara yang lebih mudah dimengerti. Dengan menggunakan diagram orbital, kita dapat melihat bagaimana elektron mengisi orbital dalam subkulit, serta bagaimana mereka mengikuti aturan tertentu dalam pengisiannya.
Cara Menyusun Diagram Orbital
Menyusun diagram orbital sangatlah mudah jika kita memahami langkah-langkah dan aturan yang harus diikuti. Berikut adalah langkah-langkah untuk menyusun diagram orbital yang benar:
1. Menuliskan Konfigurasi Elektron Berdasarkan Aturan Aufbau
Aturan Aufbau adalah prinsip yang digunakan untuk mengisi orbital dalam atom. Aturan ini menyatakan bahwa elektron akan mengisi orbital dari tingkat energi terendah terlebih dahulu sebelum mengisi orbital dengan energi yang lebih tinggi. Urutan pengisian orbital dalam subkulit mengikuti urutan spdf kimia. Di bawah ini adalah jumlah maksimum elektron yang dapat mengisi masing-masing subkulit:
- Subkulit s maksimal berisi 2 elektron
- Subkulit p maksimal berisi 6 elektron
- Subkulit d maksimal berisi 10 elektron
- Subkulit f maksimal berisi 14 elektron
Urutan penempatan elektron dari tingkat energi terendah yang benar adalah: 1s 2s 2p 3s 3p 4s 3d 4p dan seterusnya. Ini adalah urutan yang harus diikuti untuk menyusun konfigurasi elektron atom, yang membantu kita memahami bagaimana elektron mengisi orbital berdasarkan energi.
Contoh konfigurasi elektron untuk atom karbon yang memiliki 6 elektron adalah 1s² 2s² 2p², yang menunjukkan bahwa elektron pertama mengisi subkulit 1s, diikuti oleh subkulit 2s, dan sisanya mengisi subkulit 2p.
2. Dilambungkan dengan Kotak
Setelah mengetahui konfigurasi elektron atom, langkah selanjutnya adalah menggambarkan orbital dengan kotak. Dalam diagram orbital, setiap orbital dilambangkan dengan kotak, yang akan berisi anak panah yang menggambarkan elektron. Berikut adalah jumlah kotak yang digunakan untuk menggambarkan berbagai jenis orbital:
- Orbital s dilambangkan dengan 1 kotak
- Orbital p dilambangkan dengan 3 kotak
- Orbital d dilambangkan dengan 5 kotak
- Orbital f dilambangkan dengan 7 kotak
Setiap kotak mewakili satu orbital, dan kita akan mengisi kotak-kotak ini dengan elektron sesuai dengan konfigurasi elektron yang telah ditentukan.
3. Isi Kotak Orbital
Langkah selanjutnya adalah mengisi kotak orbital dengan elektron pada masing-masing subkulit. Elektron digambarkan dengan anak panah, di mana anak panah yang menghadap ke atas melambangkan elektron dengan spin +½, dan anak panah yang menghadap ke bawah melambangkan elektron dengan spin -½. Aturan yang harus diikuti dalam mengisi kotak orbital adalah:
- Asas Larangan Pauli: Menyatakan bahwa tidak ada dua elektron dalam suatu atom yang dapat memiliki empat bilangan kuantum yang sama. Dalam hal ini, setiap orbital dapat menampung maksimal dua elektron dengan arah spin yang berlawanan.
- Aturan Hund: Menyatakan bahwa dalam subkulit yang memiliki orbital dengan energi yang sama, setiap orbital harus diisi terlebih dahulu dengan satu elektron yang memiliki spin yang sama, baru kemudian diisi dengan pasangan elektron yang memiliki spin berlawanan.
Contoh diagram orbital untuk atom Oksigen (O) yang memiliki konfigurasi elektron 1s² 2s² 2p⁴ adalah sebagai berikut:
- 1s²: Dua elektron dengan spin berlawanan di kotak pertama (orbital 1s).
- 2s²: Dua elektron dengan spin berlawanan di kotak kedua (orbital 2s).
- 2p⁴: Empat elektron pada tiga kotak orbital 2p, di mana dua kotak pertama masing-masing memiliki satu elektron dengan spin yang sama, dan kotak ketiga diisi dengan dua elektron dengan spin berlawanan.
Soal Latihan Konfigurasi Elektron
Berikut adalah beberapa soal latihan yang dapat membantu Anda menguasai materi konfigurasi elektron:
- Tentukan konfigurasi elektron 17Cl!
Jawaban: Konfigurasi elektron untuk atom klor (Cl) adalah 1s² 2s² 2p⁶ 3s² 3p⁵. - Tentukan konfigurasi elektron cu!
Jawaban: Konfigurasi elektron untuk atom tembaga (Cu) adalah 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁹ (tanpa aturan penuh/setengah penuh). Dengan aturan penuh/setengah penuh, konfigurasi akan menjadi 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ 3d¹⁰. - Tentukan konfigurasi elektron untuk atom dengan nomor atom 12 (Mg)!
Jawaban: Konfigurasi elektron untuk atom magnesium (Mg) adalah 1s² 2s² 2p⁶ 3s². - Tentukan konfigurasi elektron untuk atom dengan nomor atom 15 (P)!
Jawaban: Konfigurasi elektron untuk atom fosforus (P) adalah 1s² 2s² 2p⁶ 3s² 3p³. - Tentukan konfigurasi elektron untuk atom dengan nomor atom 20 (Ca)!
Jawaban: Konfigurasi elektron untuk atom kalsium (Ca) adalah 1s² 2s² 2p⁶ 3s² 3p⁶ 4s².
Latihan soal
- Sebutkan deret bilangan kuantum yang sesuai untuk elektron 3d adalah....
Menarik, bukan? Jika Anda tertarik mempelajari kimia dan ingin memperdalam materi ini, Anda bisa mengunjungi situs Superprof untuk les privat bersama guru-guru kimia berpengalaman baik secara online maupun tatap muka. Anda juga bisa memeriksa artikel-artikel kami lainnya tentang berbagai materi kimia di website Superprof.
Ringkaskan dengan AI















Sangat membantu, terimakasih
alhamdulillah jika dirasa membantu, sama-sama