Oksidasi adalah salah satu konsep fundamental dalam kimia yang memiliki peran krusial dalam berbagai proses, baik dalam kehidupan sehari-hari maupun dalam industri. Mulai dari perkaratan logam hingga respirasi seluler, reaksi oksidasi memainkan peran vital dalam mekanisme alam dan teknologi. Dalam artikel ini, kita akan membahas secara mendalam apa itu oksidasi, arti oksidasi, berbagai jenis reaksi oksidasi, serta contoh-contoh praktis yang menunjukkan pentingnya proses ini.

Apa Itu Oksidasi?

Oksidasi adalah proses kimia di mana suatu zat kehilangan elektron. Dalam banyak kasus, proses ini melibatkan interaksi dengan oksigen, meskipun oksigen bukan satu-satunya agen oksidasi. Oksidasi seringkali diiringi dengan reaksi reduksi, di mana zat lain menerima elektron yang dilepaskan oleh zat yang teroksidasi. Oleh karena itu, reaksi oksidasi dan reduksi sering disebut sebagai reaksi redoks.
Pelajari juga mengenai 4 jenis bilangan kuantum beserta studi kasusnya.
Arti Oksidasi
Arti oksidasi dalam konteks kimia adalah peningkatan bilangan oksidasi (biloks) suatu atom dalam senyawa atau molekul. Bilangan oksidasi adalah nilai yang menunjukkan jumlah elektron yang hilang atau diperoleh oleh suatu atom dalam proses kimia. Sebagai contoh, ketika besi (Fe) bereaksi dengan oksigen (O2) untuk membentuk besi oksida (Fe2O3), besi mengalami peningkatan bilangan oksidasi dari 0 menjadi +3.
Reaksi Oksidasi
Reaksi oksidasi adalah reaksi kimia di mana suatu zat mengalami peningkatan bilangan oksidasi. Proses ini seringkali terjadi bersama dengan reaksi reduksi, di mana zat lain mengalami penurunan bilangan oksidasi. Kedua jenis reaksi ini biasanya terjadi bersamaan dalam suatu proses yang disebut reaksi redoks.
Contoh Reaksi Oksidasi: Menjelajahi Berbagai Proses Kimia
Reaksi oksidasi adalah salah satu jenis reaksi kimia yang sangat penting dalam berbagai aspek kehidupan sehari-hari dan aplikasi industri. Di bawah ini, kita akan membahas beberapa contoh reaksi oksidasi yang signifikan, menjelaskan mekanisme yang mendasarinya, dan pentingnya dalam konteks praktis.
- Pembakaran Hidrokarbon
Pembakaran hidrokarbon adalah salah satu contoh reaksi oksidasi yang paling umum. Hidrokarbon seperti metana (CH4), propana (C3H8), dan butana (C4H10) bereaksi dengan oksigen untuk menghasilkan karbon dioksida dan air, serta melepaskan energi dalam bentuk panas dan cahaya.
Contoh Reaksi:
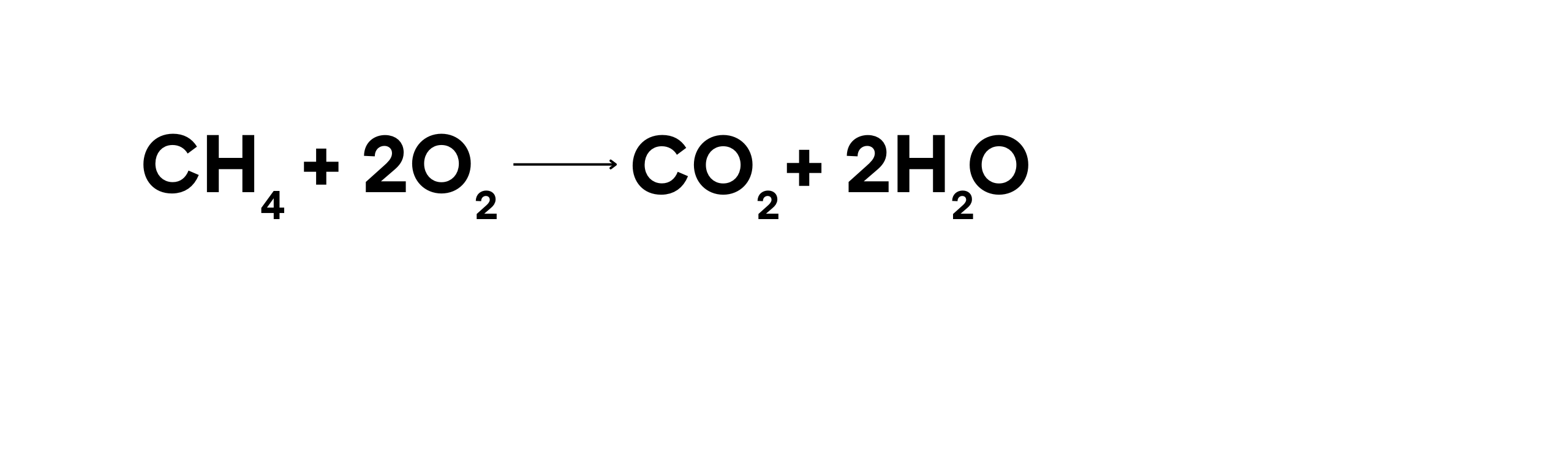
Dalam reaksi ini:
- Metana (CH4) teroksidasi menjadi karbon dioksida (CO2).
- Oksigen (O2) bertindak sebagai agen pengoksidasi.
Proses ini sangat penting dalam penggunaan bahan bakar untuk pemanas, memasak, dan sebagai sumber energi dalam mesin pembakaran internal.
- Respirasi Seluler
Respirasi seluler adalah proses biologis di mana glukosa (C6H12O6) dioksidasi untuk menghasilkan energi yang diperlukan oleh sel-sel organisme hidup. Reaksi ini terjadi di dalam mitokondria sel dan menghasilkan karbon dioksida dan air sebagai produk samping.
Contoh Reaksi:
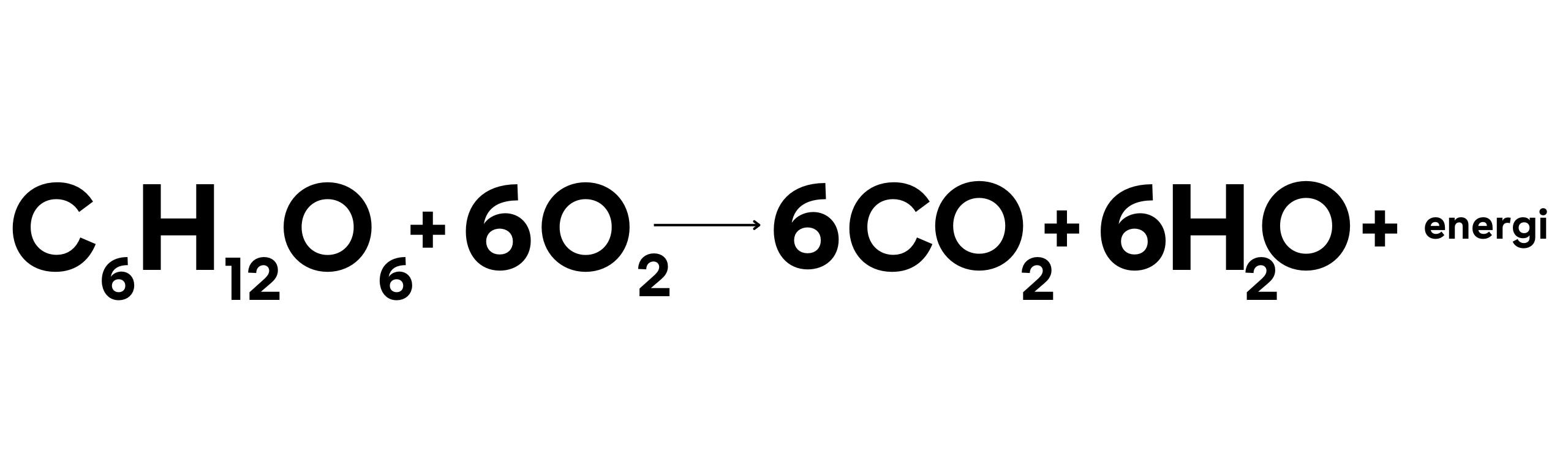
Dalam reaksi ini:
- Glukosa teroksidasi menjadi karbon dioksida.
- Oksigen tereduksi menjadi air.
Energi yang dihasilkan dari proses ini digunakan oleh sel untuk melakukan berbagai fungsi vital.
- Perkaratan Besi
Perkaratan besi adalah contoh reaksi oksidasi yang terjadi ketika besi (Fe) bereaksi dengan oksigen (O2) dan air (H2O) untuk membentuk besi oksida (Fe2O3), yang dikenal sebagai karat. Dalam proses ini, muatan Fe berubah dari 0 menjadi +3. Hal ini mengindikasikan bahwa besi mengalami oksidasi, yaitu kehilangan elektron.
Contoh Reaksi:
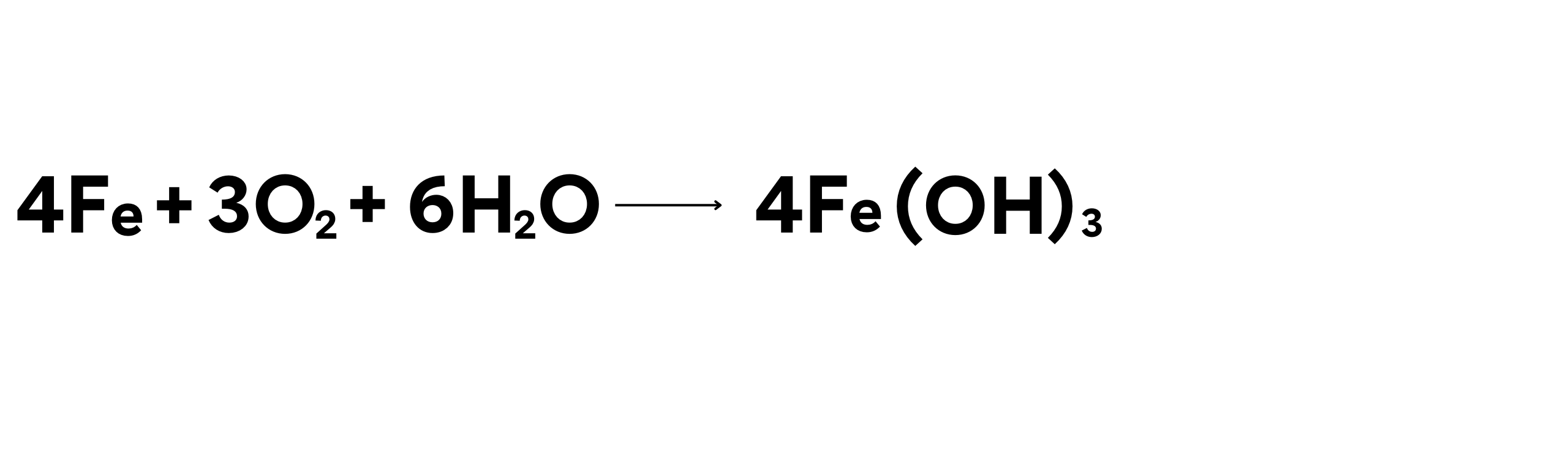
Dalam reaksi ini:
- Besi teroksidasi menjadi besi hidroksida, yang kemudian mengoksidasi lebih lanjut menjadi besi oksida (karat).
Proses perkaratan ini menyebabkan kerugian ekonomi yang signifikan dalam perawatan dan penggantian infrastruktur logam.
- Oksidasi Alkohol
Oksidasi alkohol adalah proses di mana alkohol diubah menjadi aldehida atau keton, dan selanjutnya dapat dioksidasi menjadi asam karboksilat. Proses ini penting dalam kimia organik dan industri kimia.
Contoh Reaksi (oksidasi etanol menjadi asetaldehida):
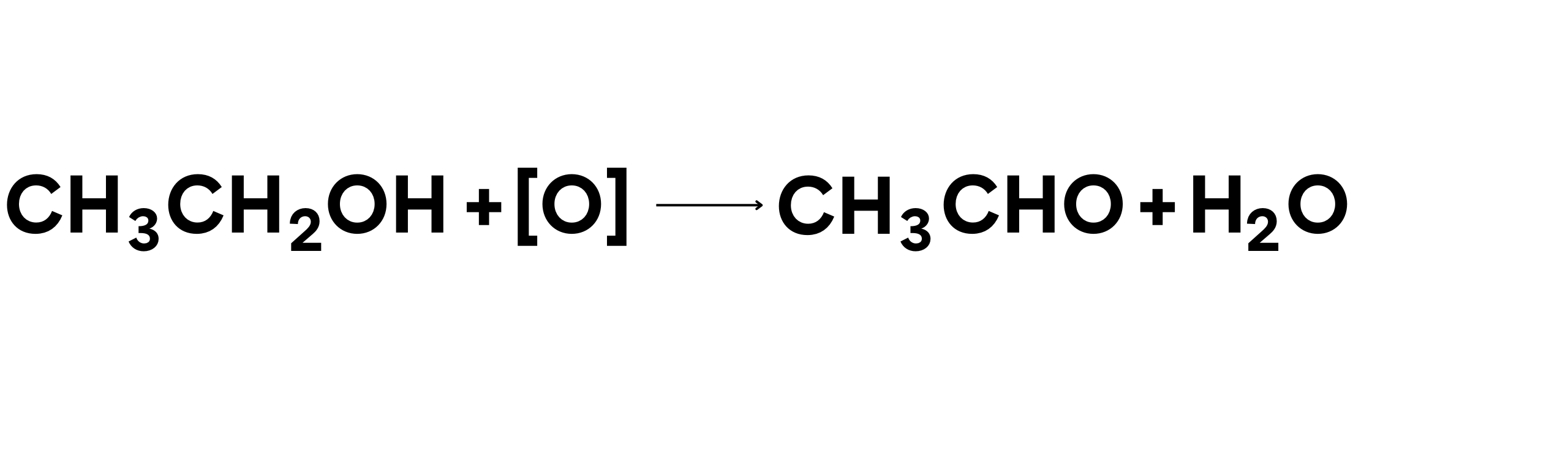
Dalam reaksi ini:
- Etanol (CH3CH2OH) teroksidasi menjadi asetaldehida (CH3CHO).
- Produksi Asam Sulfat
Produksi asam sulfat (H2SO4) melalui proses kontak adalah contoh penting dari reaksi oksidasi dalam industri kimia. Dalam proses ini, belerang dioksida (SO2) dioksidasi menjadi belerang trioksida (SO3), yang kemudian bereaksi dengan air untuk membentuk asam sulfat.
Contoh Reaksi:
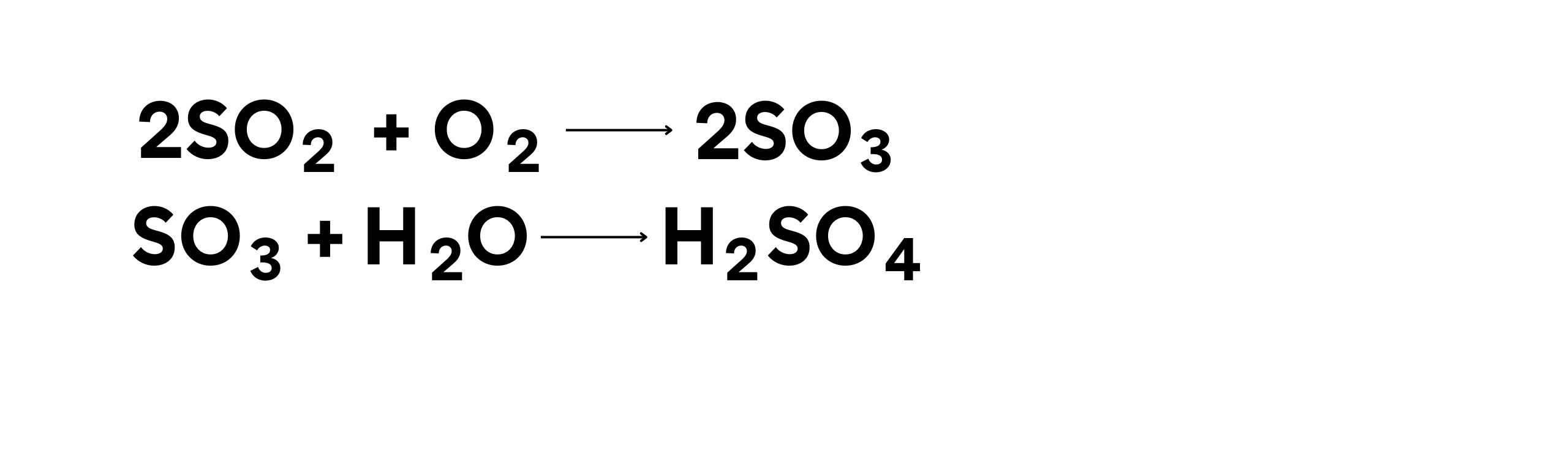
Dalam reaksi ini:
- Belerang dioksida (SO2) teroksidasi menjadi belerang trioksida (SO3).
Proses ini sangat penting dalam produksi asam sulfat, yang merupakan salah satu bahan kimia industri paling banyak digunakan.
- Fotosintesis (Tahap Oksidasi Air)
Fotosintesis adalah proses di mana tumbuhan hijau, alga, dan beberapa bakteri menggunakan energi matahari untuk mengubah karbon dioksida dan air menjadi glukosa dan oksigen. Tahap awal fotosintesis melibatkan oksidasi air untuk menghasilkan oksigen.
Contoh Reaksi:
Dalam reaksi ini:
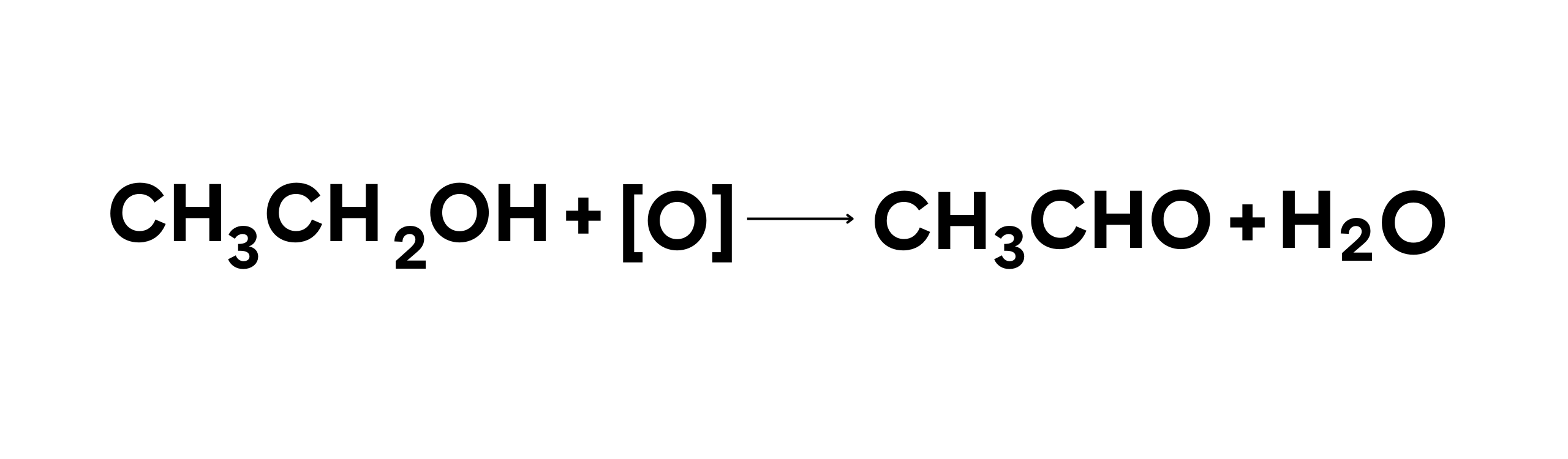
Air (H2O) teroksidasi menjadi oksigen (O2).Tahap ini sangat penting karena menyediakan elektron yang diperlukan untuk tahap selanjutnya dalam proses fotosintesis, serta menghasilkan oksigen yang esensial bagi kehidupan aerobik di Bumi.
Contoh Soal Reaksi Redoks (Oksidasi)
Berikut adalah beberapa contoh soal reaksi redoks yang dapat membantu Anda memahami bagaimana bilangan oksidasi berubah dalam suatu reaksi kimia. Dalam reaksi redoks, selalu ada dua proses yang terjadi bersamaan, yaitu oksidasi (peningkatan biloks) dan reduksi (penurunan biloks).
Contoh 1: Reaksi Redoks Pembakaran Metana
Reaksi pembakaran metana (CH₄) adalah contoh reaksi redoks, di mana metana teroksidasi, dan oksigen tereduksi. Berikut adalah contoh soal untuk reaksi ini:
Tuliskan reaksi redoks antara metana (CH₄) dan oksigen (O₂), dan tentukan perubahan bilangan oksidasi dari unsur yang terlibat.
Jawaban:
- CH₄ + 2O₂ → CO₂ + 2H₂O
- Dalam reaksi ini, karbon (C) mengalami peningkatan biloks dari -4 menjadi +4 (oksidasi), sedangkan oksigen (O₂) mengalami penurunan biloks dari 0 menjadi -2 (reduksi).
Contoh 2: Reaksi Redoks pada Proses Perkaratan Besi
Perkaratan besi adalah reaksi redoks yang sangat umum. Dalam proses ini, besi (Fe) teroksidasi, sedangkan oksigen (O₂) tereduksi.
Tuliskan reaksi redoks untuk perkaratan besi dan tentukan perubahan bilangan oksidasi dari unsur-unsur yang terlibat.
Jawaban:
- 3Fe + 4O₂ → 2Fe₂O₃
Dalam reaksi ini, besi (Fe) mengalami peningkatan biloks dari 0 menjadi +3 (oksidasi), sedangkan oksigen (O₂) mengalami penurunan biloks dari 0 menjadi -2 (reduksi).
Lanjutkan membaca artikel Superprof ini untuk memahami bentuk-bentuk bilangan kuantum beserta contohnya!
Apa Itu Biloks?
Mungkin kamu bertanya-tanya sebenarnya apa itu bilangan oksidasi? Biloks atau bilangan oksidasi adalah angka yang digunakan untuk menggambarkan banyaknya elektron yang dilepaskan atau diterima oleh suatu atom ketika ia berikatan dengan atom lain dalam sebuah senyawa. Biloks ini sangat penting dalam memahami reaksi kimia, terutama dalam cara menentukan reaksi redoks.
Sederhananya, biloks adalah bilangan menunjukkan "status" atom dalam sebuah senyawa—apakah ia cenderung memberi elektron (oksidasi) atau menerima elektron (reduksi). Setiap atom di senyawa memiliki biloks yang berbeda, dan itu yang membuat reaksi redoks begitu menarik. Biloks ini memudahkan kita untuk melacak apa yang terjadi dengan elektron-elektron dalam suatu reaksi kimia.
Sebagai contoh, dalam senyawa natrium bromida (NaBr), biloks Br adalah -1, karena bromin menerima elektron dari natrium. Namun, pada senyawa seperti bromin dioksida (BrO₂), biloks Br bisa lebih tinggi, yaitu +5, yang menunjukkan bahwa bromin mengalami oksidasi dalam reaksi tersebut. Pemahaman biloks Br sangat penting dalam menganalisis berbagai reaksi redoks yang melibatkan bromin. Selain itu, dalam senyawa seperti tembaga(II) sulfat (CuSO₄), biloks Cu adalah +2, menunjukkan bahwa tembaga kehilangan dua elektron. Sebaliknya, dalam senyawa tembaga(I) klorida (CuCl), biloks Cu adalah +1, karena tembaga hanya kehilangan satu elektron. Pemahaman mengenai muatan Cu penting dalam menganalisis berbagai reaksi yang melibatkan tembaga, seperti dalam reaksi redoks di industri atau dalam proses biologis. Ada juga biloks al.

Aturan Bilangan Oksidasi
Nah, sekarang kita sudah tahu apa itu biloks. Sekarang saatnya kita mengenal beberapa aturan dalam menentukan biloks. Memahami aturan ini bakal membantumu memecahkan soal-soal kimia dengan lebih mudah. Berikut adalah 8 aturan biloks yang perlu kamu ketahui!
- Unsur Bebas Memiliki Biloks Nol
Unsur bebas merupakan suatu unsur yang tidak bergabung atau tidak mempunyai ikatan secara kimia dengan unsur lain. Unsur bebas sendiri terbagi menjadi dua macam, yaitu unsur bebas dalam bentuk atom C, Ca, Cu, Na, Fe, Al, Ne dan unsur bebas dalam bentuk molekul H2, O2, Cl2, P4, S8. Unsur-unsur di atas akan memiliki bilangan oksidasi 0.. Mudah kan? - Bilangan Oksidasi Ion Monoatomik Sama Dengan Muatannya
Ion Monoatom:
- K+: Bilangan oksidasi adalah +1
- Ca2+: Bilangan oksidasi adalah +2
- Fe3+: Bilangan oksidasi adalah +3
Ion Poliatom:
- NO3- (ion nitrat): Bilangan oksidasi adalah -1
- CO32- (ion karbonat): Bilangan oksidasi adalah -2
- Cr2O72- (ion dikromat): Bilangan oksidasi adalah -2 (untuk setiap oksigen, dan +6 untuk kromium, dengan jumlah total -2 untuk seluruh ion)
Contoh di atas menunjukkan variasi dalam bilangan oksidasi ion monoatom dan poliatom dengan muatan yang berbeda. Jadi, ion monoatomik itu gampang diingat, kan? - Jumlah Bilangan Oksidasi Semua Atom dalam Senyawa Sama Dengan Nol
Dalam kimia, salah satu prinsip dasar yang penting adalah aturan bahwa jumlah bilangan oksidasi s (biloks) dari semua atom dalam sebuah senyawa harus sama dengan nol. Hal ini berlaku karena senyawa secara keseluruhan tidak memiliki muatan listrik, sehingga biloks yang saling berlawanan harus saling mengimbangi untuk menghasilkan keseimbangan netral. Sebagai contoh, dalam senyawa natrium klorida (NaCl), biloks natrium (Na) adalah +1, sementara biloks klor (Cl) adalah -1. Jika kedua bilangan oksidasi ini dijumlahkan, hasilnya adalah 0, yang menunjukkan bahwa senyawa ini bersifat netral tanpa muatan.
Aturan ini penting dalam analisis senyawa karena membantu menentukan bilangan oksidasi unsur-unsur lainnya dalam senyawa kompleks. Dengan memahami bahwa jumlah total bilangan oksidasi dalam senyawa harus selalu nol, kita bisa mengidentifikasi atau menghitung biloks unsur yang belum diketahui. Misalnya, dalam senyawa H₂O, biloks hidrogen (H) adalah +1 dan biloks oksigen (O) adalah -2. Jika dijumlahkan (2 x +1) + (-2) = 0, yang menunjukkan bahwa air adalah senyawa netral. Dengan demikian, aturan ini memudahkan kita untuk menyusun rumus dan memahami sifat kimia senyawa yang terlibat.
Kalau dalam senyawa, jumlah biloks seluruh atom harus nol. Misalnya, dalam senyawa NaCl, biloks Na adalah +1 dan biloks Cl adalah -1. Kalau ditambahkan, hasilnya 0—sesuai aturan! Cukup simpel, bukan? - Ion Poliatomik Memiliki Biloks Sama Dengan Muatannya
Ion poliatomik adalah ion yang terdiri dari lebih dari satu atom yang terikat bersama dengan muatan total. Untuk menentukan bilangan oksidasi (biloks) atom-atom dalam ion tersebut, kita harus memastikan bahwa jumlah biloks atom-atom dalam ion itu sama dengan muatan total ion. Misalnya, pada ion SO₄²⁻, total muatan ionnya adalah -2. Dengan demikian, jumlah biloks seluruh atom dalam ion ini harus berjumlah -2. Ini berarti bilangan oksidasi atom-atom dalam ion tersebut harus dihitung dengan memperhatikan jumlah total muatan yang ditanggung oleh ion itu.
Proses ini melibatkan penetapan bilangan oksidasi untuk setiap atom yang membentuk ion, dengan aturan tertentu yang harus dipatuhi. Sebagai contoh, dalam ion SO₄²⁻, oksidasi atom belerang (S) sering dianggap sebagai +6, sedangkan setiap atom oksigen (O) memiliki bilangan oksidasi -2. Dengan demikian, jumlah total bilangan oksidasi dalam ion ini harus sama dengan muatan total ionnya, yaitu -2. Jadi, memahami hubungan antara biloks dan muatan ion sangat penting untuk menghitung dan menafsirkan sifat kimia dari ion poliatomik dengan benar. Jadi, perhatikan muatan ionnya ya! - Bilangan Oksidasi Unsur Oksigen Umumnya -2
Bilangan oksidasi (biloks) unsur oksigen umumnya adalah -2. Ini berarti, dalam sebagian besar senyawa, oksigen bertindak sebagai oksidator dengan menarik elektron lebih kuat dari unsur lainnya. Sebagai contoh, dalam air (H₂O) atau oksida logam, oksigen memiliki bilangan oksidasi -2. Karakteristik ini konsisten dalam berbagai senyawa yang mengandung oksigen, sehingga kita dapat dengan mudah mengetahui biloks oksigen dalam sebagian besar kasus.
Namun, ada pengecualian dalam beberapa senyawa, seperti peroksida, di mana bilangan oksidasi oksigen menjadi -1. Pada senyawa peroksida, seperti hidrogen peroksida (H₂O₂), oksigen memiliki biloks -1 karena ikatan peroksida mengandung dua atom oksigen yang terikat bersama dengan ikatan tunggal, menyebabkan pembagian elektron yang berbeda. Mengetahui aturan umum ini, termasuk pengecualian pada peroksida, akan mempermudah dalam menentukan biloks oksigen di berbagai senyawa kimia. - Bilangan Oksidasi Hidrogen Biasanya +1
Hidrogen dalam senyawa biasa memiliki biloks +1. Namun, ketika hidrogen berikatan dengan logam (seperti NaH), biloksnya bisa menjadi -1. Jadi, kamu perlu memperhatikan jenis ikatan hidrogen dalam senyawa. - Bilangan Oksidasi Unsur Golongan Alkali (IA) adalah +1
Semua unsur golongan alkali (Li, Na, K, dan teman-temannya) memiliki biloks +1 dalam semua senyawa mereka. Jadi, jika kamu menemukan Na, kamu sudah tahu: biloksnya +1. Gampang, kan? - Bilangan Oksidasi Golongan Alkali Tanah (IIA) adalah +2
Sama seperti golongan alkali, unsur golongan alkali tanah (Be, Mg, Ca, dll) selalu memiliki biloks +2 dalam senyawanya. Jadi, tidak perlu bingung dengan senyawa-senyawa yang melibatkan unsur-unsur ini.
Biloks i₂ dalam Senyawa Halogen
Biloks i2 (iodin molekular) bervariasi tergantung pada senyawa yang terbentuk, dan iodin sering kali menunjukkan bilangan oksidasi yang berbeda-beda. Sebagai halogen, iodin dapat mengalami perubahan bilangan oksidasi dalam reaksi redoks dan senyawa-senyawa yang mengandungnya. Berikut adalah beberapa contoh biloks i₂:
NaI (Natrium Iodida): Dalam senyawa ini, biloks i₂ adalah -1, karena iodin berperan sebagai agen pengoksidasi, menerima elektron dari natrium yang memiliki biloks +1.
I₂O₅ (Iodin Pentoksida): Dalam senyawa ini, biloks i₂ lebih tinggi, yaitu +5, yang menunjukkan bahwa iodin mengalami oksidasi.
Pemahaman tentang biloks i₂ sangat penting dalam menganalisis reaksi kimia yang melibatkan halogen, baik dalam senyawa organik maupun anorganik. Biloks iodin membantu kita memahami bagaimana iodin berinteraksi dengan elemen lain dalam reaksi redoks.
Contoh Soal Bilangan Oksidasi
1. Tentukan bilangan oksidasi atom dari Fe2O3!
Pada soal diatas, kita diminta untuk menentukan biloks Fe yang ada di dalam senyawa Fe2O3. Mari ingat kembali aturan yang terdapat pada biloks nomor 6 bahwa jumlah biloks unsur-unsur pembentuk senyawa adalah 0.
Fe2O3 = 0
Biloks O = -2. Karena atom O memiliki indeks 3, maka biloks O dikalikan dengan indeks O = -2 x 3 = -6. Agar jumlah biloks Fe dan O = 0, maka biloks Fe haruslah bernilai +6. Tapi, karena atom Fe punya indeks 2, maka biloks Fe : indeks Fe = +6 : 2 = +3. Jadi, biloks Fe2 = +3.
2. Contoh lain adalah NaCl (natrium klorida). Dalam senyawa ini, biloks Na adalah +1, dan biloks Cl adalah -1, yang menjadikan senyawa ini netral. Selain itu, BM NaCl (berat molekul NaCl) adalah 58,44 g/mol, yang dihitung dari penjumlahan berat atom natrium (Na) dan klor (Cl), yakni 22,99 g/mol (Na) + 35,45 g/mol (Cl) = 58,44 g/mol.
3. Tentukan bilangan oksidasi atom dari Ca pada senyawa CaCO₃!
Biloks O = -2 (untuk 3 atom O)
Biloks C = +4 (karena C dalam karbonat (CO₃²⁻) memiliki biloks +4)
Gunakan aturan bahwa jumlah biloks dalam senyawa harus nol:
(1×biloks Ca)+(1×biloks C)+(3×biloks O)=0(1 \times \text{biloks Ca}) + (1 \times \text{biloks C}) + (3 \times \text{biloks O}) = 0(1×biloks Ca)+(1×biloks C)+(3×biloks O)=0 biloks Ca+4+(−6)=0\text{biloks Ca} + 4 + (-6) = 0biloks Ca+4+(−6)=0 biloks Ca=+2\text{biloks Ca} = +2biloks Ca=+2 Jadi, biloks Ca dalam senyawa CaCO₃ adalah +2.
Meskipun ada aturan baku untuk menentukan bilangan oksidasi (biloks), beberapa senyawa memiliki pengecualian yang perlu diingat. Berikut adalah beberapa pengecualian penting:
Pengecualian dalam Aturan Bilangan Oksidasi
- F₂O: Bilangan Oksidasi O adalah +2
Biasanya, oksigen memiliki biloks -2. Namun, pada F₂O (difluorida oksigen), oksigen memiliki biloks +2 karena fluor lebih elektronegatif dan menarik elektron lebih kuat dari oksigen. - KO₂: Bilangan Oksidasi O adalah -½
Pada KO₂ (kalium superoksida), oksigen memiliki biloks -½. Hal ini terjadi karena ikatan oksigen dalam superoksida lebih lemah dan lebih reaktif daripada senyawa oksigen biasa. - Peroksida (H₂O₂, Na₂O₂, BaO₂): Bilangan Oksidasi O adalah -1
Dalam senyawa peroksida seperti H₂O₂ (hidrogen peroksida), oksigen memiliki biloks -1, bukan -2. Ini karena peroksida memiliki ikatan oksigen-oksigen yang berbeda dengan senyawa oksigen lainnya. - Hidrida Logam (NaH, CaH₂, AlH₃): Bilangan Oksidasi H adalah -1
Biasanya, hidrogen memiliki biloks +1. Namun, dalam hidrida logam seperti NaH, biloks hidrogen menjadi -1 karena berikatan dengan logam yang lebih elektropositif.
Contoh Soal Biloks
Sekarang setelah memahami aturan biloks, mari kita lihat beberapa contoh soal untuk melatih kemampuanmu. Tidak perlu khawatir, soal-soal ini sudah dilengkapi dengan penjelasan supaya kamu bisa paham dan mudah mengingatnya. Let's go!
- Tentukan biloks S pada senyawa H₂SO₄!
Pembahasan:- Biloks H = +1 (untuk H₂)
- Biloks O = -2 (untuk 4 atom O)
- Gunakan aturan bahwa jumlah biloks dalam senyawa harus nol:
2(+1) + biloks S + 4(-2) = 0
2 + biloks S - 8 = 0
Biloks S = +6
- Tentukan biloks Cr pada ion Cr2o7²⁻!
Pembahasan:- Biloks O = -2 (untuk 7 atom O)
- Muatan total ion adalah -2, jadi:
2(biloks Cr) + 7(-2) = -2
2(biloks Cr) - 14 = -2
Biloks Cr = +6
- Tentukan biloks N pada senyawa NaNO₃!
Pembahasan:- Biloks Na = +1
- Biloks O = -2 (untuk 3 atom O)
- 1(+1) + biloks N + 3(-2) = 0
Biloks N = +5
- Tentukan biloks C pada senyawa Na₂C₂O₄!
Pembahasan:- Biloks Na = +1
- Biloks O = -2 (untuk 4 atom O)
- 2(+1) + 2(biloks C) + 4(-2) = 0
Biloks C = +3
- Tentukan biloks Sn pada senyawa SnCl₂!
Pembahasan:- Biloks Cl = -1
- 1(biloks Sn) + 2(-1) = 0
Biloks Sn = +2
Dengan memahami biloks dan aturan-aturan yang menyertainya, kamu bisa lebih mudah menentukan bilangan oksidasi dalam berbagai senyawa. Jangan lupa, rumus redoks juga terlibat dalam perubahan biloks yang terjadi selama reaksi. Jika anda merasa kesulitan memahami biloks, jangan ragu untuk mencari les privat di Superprof! Temukan guru kimia terbaik di sekitar anda yang siap membantu menjelaskan materi biloks dan reaksi redoks dengan cara yang mudah dipahami.
Selain itu, Superprof punya artikel lain tentang konfigurasi elektron dan diagram orbital yang bisa membantu Anda memahami subjek kimia lebih jauh!
Ringkaskan dengan AI















Agar tali silaturahmi tidak terputus,adakah seratus min
haha belum ada nih, coba pinjem sama yang lain