Molekul adalah bagian terkecil zat yang masih memiliki sifat-sifat yang sama dengan zatnya. Molekul merupakan pembawa sifat, sehingga apabila susunan atom dalam molekul berubah, maka sifat zatnya pun akan berubah.
Mengutip dari buku Kimia, perubahan sifat materi atau zat disebabkan oleh perubahan susunan atom dan molekulnya.
Pada materi kimia sekolah menengah, Anda tentu pernah belajar mengenai ikatan kimia. Apa yang Anda ingat pada sub bab tersebut? Ikatan kimia ini adalah ikatan antar atom yang membentuk suatu molekul kimia. Seperti atom Na dan Cl yang akan membuat bentuk molekul NaCl (garam dapur). Ikatan ini memiliki berbagai variasi bentuk. Salah satu cara untuk meramalkan bentuk bentuk molekul tersebut adalah berdasarkan gaya tolak menolak elektrostatik antar pasangan elektron. Gaya tersebut yang nantinya akan memberikan susunan sedemikian rupa hingga berada pada tingkat energi potensial yang serendah mungkin.
Dan sekarang pertanyaannya; “Bagaimana cara menyusun geometri molekul-molekul tersebut?”, “Ada berapa macam model molekul dari suatu geometri molekul?”, atau “Teori apakah yang mendasari tentang peramalan dari geometri suatu molekul tersebut?”
Artikel ini akan membahas tentang pengertian bentuk molekul, apa saja tipe molekul, dan bentuk-bentuk molekul.
Jika Anda kesulitan memahami materi kimia, kursus privat kimia bersama Superprof akan membantu Anda belajar dengan lebih mudah dan menyenangkan.

Pengertian Bentuk Molekul
Molekul adalah gabungan dari dua atom atau lebih yang terdapat dalam suatu susunan tertentu dan terikat oleh gaya kimia.
Bentuk geometri molekul bisa bervariasi karena atom-atom yang saling berikatan akan membentuk berbagai senyawa atau molekul yang berbeda-beda agar stabil. Bentuk tersebut berdasarkan jumlah pasangan elektron terikat (PEI), pasangan elektron bebas (PEB), dan domain elektron.
Untuk mengetahui PEI, PEB, dan domain elektron, Anda memerlukan gambaran struktur lewis pada suatu senyawa. Struktur lewis adalah struktur yang menggambarkan bagaimana keadaan elektron-elektron valensi atom-atom saling berpasangan dan saling berikatan secara kovalen. Di dalam struktur lewis terdapat PEI dan PEB.
Pasangan elektron terikat (PEI) adalah pasangan elektron yang terikat antara atom pusat dengan atom lain secara kovalen. Sementara, Pasangan elektron bebas (PEB) adalah pasangan elektron bebas pada atom pusat yang tidak terikat dengan atom lain, dan domain elektron adalah total dari pasangan elektron terikat dan bebas. Setiap pasangan elektron (ikatan rangkap 2 atau rangkap 3) akan bernilai satu domain. Contoh pembentukan senyawa PEI, PEB, dan domain Elektron menggunakan struktur lewis adalah sebagai berikut:

Dari gambar terlihat bahwa pasangan elektron pada molekul HCl yaitu terdapat:
1 pasangan elektron terikat (PEI)
3 pasangan elektron bebas (PEB)
Sehingga jumlah domain elektron = 3 + 1 = 4

Dari gambar terlihat bahwa pasangan elektron pada molekul H2O yaitu terdapat:
2 pasangan elektron terikat (PEI)
2 pasangan elektron bebas (PEB)
Sehingga jumlah domain elektron = 2 + 2 = 4
Itulah pengertian bentuk molekul, klik di sini untuk mempelajari pengertian kesetimbangan kimia!
Tipe Bentuk Molekul
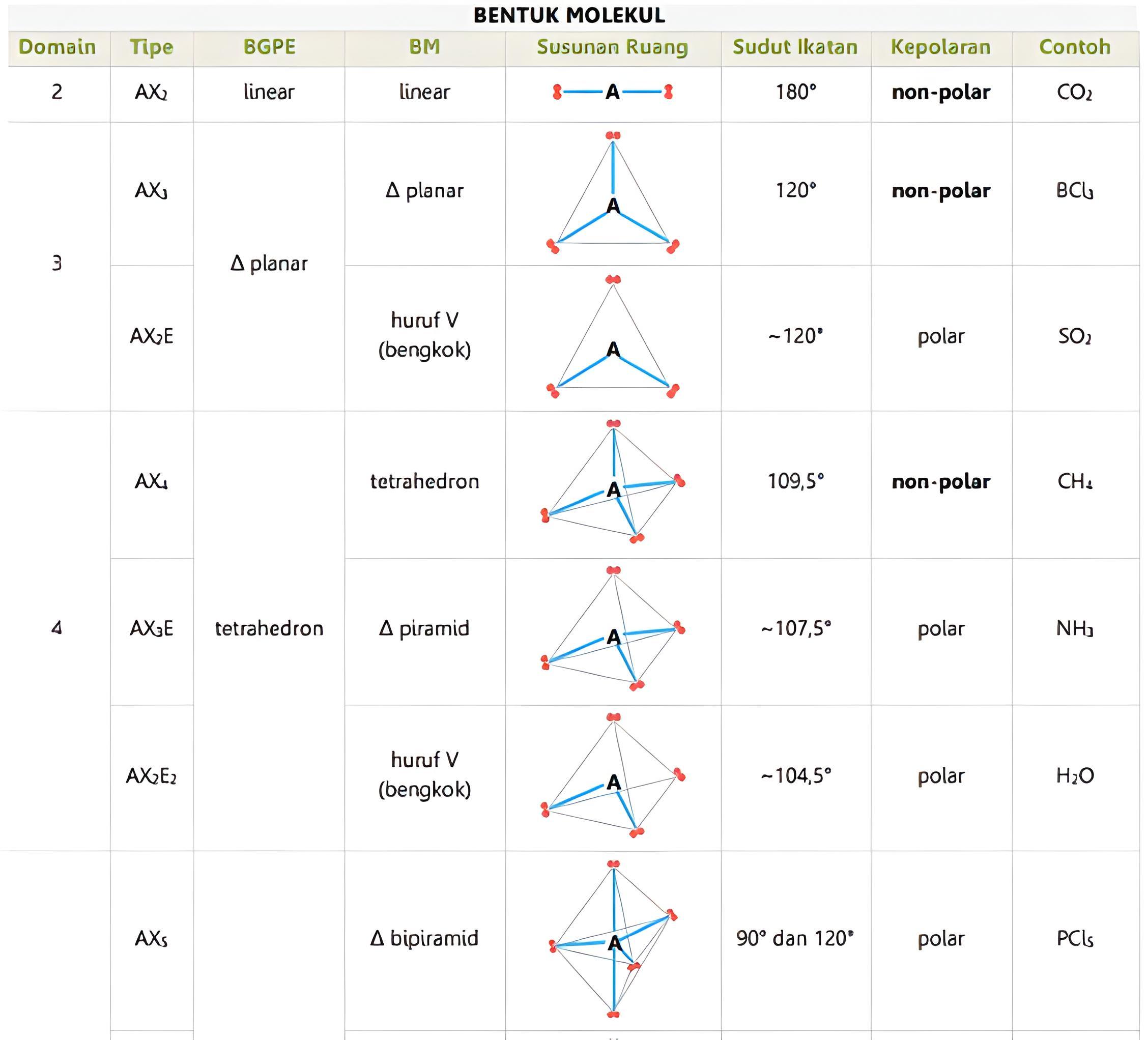
Bentuk suatu Molekul berkaitan dengan susunan ruang atom-atom dalam molekul. Terdapat tujuh bentuk molekul dasar, yaitu:
Bentuk linear
Suatu molekul dikatakan linear jika atom-atom yang menyusun molekul tersebut berada dalam suatu garis lurus. Contohnya, BeCl2, dan CO2. Sudut yang dibentuk oleh ikatan antara dua atom melalui atom pusat sebesar 180°.
Jika ingin belajar tentang rumus molekul dan rumus empiris, baca artikel Kami lainnya!
Trigonal planar
Suatu bentuk molekul dikatakan trigonal planar jika di dalam molekulnya terdapat empat buah atom dan semua atom berada pada bidang yang sama. Atom pusat dikelilingi oleh tiga atom lain yang berada pada sudut-sudut segitiga. Sudut ikatan yang dibentuk di antara dua ikatan melalui atom pusat sama besar yaitu 120°. Contohnya, molekul BCI3, dan BF3.
Trigonal piramidal
Trigonal piramidal adalah suatu bentuk molekul dengan empat buah muka segitiga sama sisi. Suatu molekul dikatakan berbentuk trigonal piramidal jika memilki empat buah atom. Atom pusat ditempatkan pada sudut puncak limas, dan atom lainnya berada pada sudut-sudut limas yang berada pada bidang datar segitiga. Contohnya, molekul NH3.
Bujur sangkar
Suatu bentuk molekul dikatakan bujur sangkar jika dalam molekul terdapat lima buah atom dan semua atom berada pada bidang datar yang sama. Atom pusat dikelilingi oleh empat atom lain yang berada pada sudut-sudut segiempat. Sudut ikatan yang dibentuk antara dua ikatan yang melalui pusat sama besar, yaitu 90°. Contohnya, molekul XeF4.
Klik di sini untuk mempelajari tentang titrasi asam basa!
Tetrahedral
Tetrahedral adalah limas segiempat dengan muka segitiga sama sisi. Tetrahedral terdiri dari molekulnya yang terdapat lima buah atom. Atom pusat ditempatkan pada pusat tetrahedral dan empat atom lain berada pada sudut-sudut tetrahedral yang terlihat pada ujung-ujung bidang segitiga sama sisi. Sudut ikatan yang dibentuk sama besar, yaitu 109,5". Contohnya, molekul CH4.
Trigonal bipiramidal
Trigonal bipiramidal terdiri atas dua buah limas yang bagian alasnya berimpit dengan enam buah atom.
Dalam trigonal bipiramidal, atom pusat ditempatkan pada pusat alas yang berimpit dan dikelilingi oleh lima atom lain yang ditempatkan pada sudut-sudut trigonal bipiramidal. Contohnya molekul PCl5
Oktahedral
Oktahedral adalah bentuk yang memiliki delapan muka segitiga, dibentuk dari dua buah limas alas segiempat yang berimpit dan tersusun dari tujuh atom. Atom pusat ditempatkan pada pusat bidang segiempat yang berimpit. Enam atom lain terletak pada sudut-sudut okrahedral. Sudut antarikatan yang terbentuk sama besar, yaitu 90°. Contohnya, molekul SF6, dan XeF6.
Kita dapat menentukan bentuk suatu molekul dari hasil percobaan atau dengan meramalkan bentuk molekul melalui pemahaman struktur elektron dalam Molekul.
Pahami juga tipe atau jenis koloid dalam tulisan Kami!
Teori Bentuk Molekul
Teori yang membahas tentang bentuk suatu molekul ada tiga, yaitu Teori VSEPR (Valence Shell Electron Pair Repulsion), Teori Domain Elektron, dan Teori Hibridisasi.
Teori VSEPR
Bunyi teori VSEPR adalah pasangan elektron dalam ikatan kimia ataupun pasangan elektron yang tidak dipakai bersama (yaitu pasangan elektron “mandiri”) saling tolak-menolak, pasangan elektron cenderung untuk berjauhan satu sama lain. Teori ini menggambarkan arah pasangan elektron terhadap inti suatu atom.
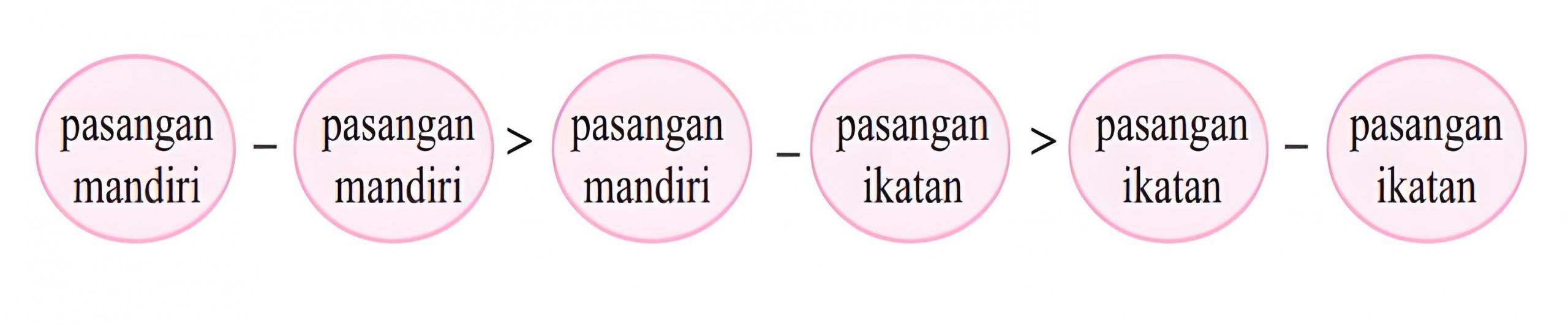
Gaya tolak-menolak antara dua pasang elektron akan semakin kuat dengan semakin kecilnya jarak antara kedua pasang elektron tersebut. Gaya tolakan akan semakin kuat jika sudut di antara kedua pasang elektron tersebut besarnya 900. Tidak hanya itu, tolakan yang melibatkan pasangan elektron tunggal lebih kuat daripada yang melibatkan pasangan ikatan. Di bawah ini adalah urutan bersanya gaya tolakan antara dua pasang elektron menurut teori VSEPR.
Teori Domain Molekul
Bentuk suatu molekul berdasarkan teori domain elektron didasarkan pada jumlah pasangan elektron ikatan dan elektron bebas atau kedudukan suatu elektron.
Sobat Zenius bisa melihat elektron-elektron tersebut dari struktur lewisnya. Prinsip dari teori ini adalah sebagai berikut:
Antar domain elektron pada atom pusat saling tolak menolak, dengan begitu mereka akan saling mengatur diri dan tolakannya menjadi minimum.
Kekuatan tolakan dari domain elektron yaitu: PEB – PEB > PEB – PEI > PEI – PEI. Akibat dari adanya perbedaan kekuatan tersebut yaitu mengecilnya sudut ikatan pada bentuk molekulnya.
Bentuk suatu molekul hanya ditentukan oleh pasangan elektron ikatan (PEI).
Teori domain elektron menggunakan rumus:
A Xm En
Keterangan:
A : atom pusat
Xm : jumlah domain elektron ikatan (PEI)
En : jumlah domain elektron bebas (PEB)
Ada 11 bentuk molekul berdasarkan teori ini, antara lain: linear (AX2), segitiga planar (AX3), segiempat piramida (AX5E), T-shape (Ax3E2), dll.
Teori Hibridisasi
Teori selanjutnya yang dapat digunakan untuk memprediksi bentuk molekul yaitu teori hibridisasi. Teori hibridisasi adalah teori yang mengacu pada proses hibridisasi yaitu proses penggabungan orbital-orbital asli dengan tingkat energi berbeda menjadi orbital-orbital baru dengan tingkat energi sama.
Belajar lebih mudah dan menyenangkan bersama kursus privat.
















